Máquinas térmicas
Una máquina térmica es un dipositivo cuyo objetivo es convertir calor en trabajo. Para ello utiliza de una sustancia de trabajo (vapor de agua, aire, gasolina) que realiza una serie de transformaciones termodinámicas de forma cíclica, para que la máquina pueda funcionar de forma continua. A través de dichas transformaciones la sustancia absorbe calor (normalmente, de un foco térmico) que transforma en trabajo.
El desarrollo de la Termodinámica y más en concreto del Segundo Principio vino motivado por la necesidad de aumentar la cantidad de trabajo producido para una determinada cantidad de calor absorbido. De forma empírica, se llega así al primer enunciado del Segundo Principio:
Enunciado de Kelvin-Planck
Este enunciado implica que la cantidad de energía que no ha podido ser transformada en trabajo debe cederse en forma de calor a otro foco térmico, es decir, una máquina debe trabajar al menos entre dos focos térmicos. El esquema más sencillo de funcionamiento es entonces el siguiente:

Como la máquina debe trabajar en ciclos, la variación de energía interna es nula. Aplicando el Primer Principio el trabajo producido se puede expresar:
 
En general, se define Potencia (P) como el trabajo dividido por el tiempo, en caso de las máquinas corresponde entonces al trabajo producido en un segundo. En el S.I. de Unidades se mide en Watios (J/s)
 Rendimiento (η)
El objetivo de una máquina es aumentar la relación entre el trabajo producido y el calor absorbido; se define pues el rendimiento como el cociente entre ambos. Si tenemos en cuenta la limitación impuesta por enunciado de Kelvin-Planck, el trabajo es siempre menor que el calor absorbido con lo que el rendimientosiempre será menor que uno:
Habitualmente se expresa el rendimiento en porcentaje, multiplicando el valor anterior por cien. Para las máquinas más comunes este rendimiento se encuentra en torno al 20%.
Usando la expresión anterior del trabajo, el rendimiento se puede calcular también como:
 |
lunes, 7 de diciembre de 2015
Energía interna
La magnitud que designa la energía almacenada por un sistema de partículas se denomina energía interna (U). La energía interna es el resultado de la contribución de la energía cinética de las moléculas o átomos que lo constituyen, de sus energías de rotación, traslación y vibración, además de la energía potencial intermolecular debida a las fuerzas de tipo gravitatorio, electromagnético y nuclear.
La energía interna es una función de estado: su variación entre dos estados es independiente de la transformación que los conecte, sólo depende del estado inicial y del estado final.

Como consecuencia de ello, la variación de energía interna en un ciclo es siempre nula, ya que el estado inicial y el final coinciden:

Energía interna de un gas ideal
Para el caso de un gas ideal puede demostrarse que la energía interna depende exclusivamente de la temperatura, ya en un gas ideal se desprecia toda interacción entre las moléculas o átomos que lo constituyen, por lo que la energía interna es sólo energía cinética, que depende sólo de la temperatura. Este hecho se conoce como la ley de Joule.
La variación de energía interna de un gas ideal (monoatómico o diatómico) entre dos estados A y B se calcula mediante la expresión:

donde n es el número de moles y Cv la capacidad calorífica molar a volumen constante. Las temperaturas deben ir expresadas en Kelvin.
Para demostrar esta expresión imaginemos dos isotermas caracterizadas por sus temperaturas TA y TB como se muestra en la figura.

Un gas ideal sufrirá la misma variación de energía interna (ΔUAB) siempre que su temperatura inicial sea TA y su temperatura final TB, según la Ley de Joule, sea cual sea el tipo de proceso realizado.
Elijamos una transformación isócora (dibujada en verde) para llevar el gas de la isoterma TA a otro estado de temperatura TB. El trabajo realizado por el gas es nulo, ya que no hay variación de volumen. Luego aplicando el Primer Principio de la Termodinámica:

El calor intercambiado en un proceso viene dado por:

siendo C la capacidad calorífica. En este proceso, por realizarse a volumen constante, se usará el valor Cv (capacidad calorífica a volumen constante). Entonces, se obtiene finalmente:

Esta expresión permite calcular la variación de energía intena sufrida por un gas ideal, conocidas las temperaturas inicial y final y es válida independientemente de la transformación sufrida por el gas.
Un gas que ocupa 6 L se comprime a una presión constante de 3 atm hasta un volumen de 2 L. Durante la compresión, el gas absorbe 5000 J de un foco caliente. Calcula:
a) El trabajo realizado.
b) La variación de energía interna del gas.
a) El trabajo realizado.
b) La variación de energía interna del gas.
SOLUCIÓN
a)  ; b)
; b) 
EQUILIBRIO TÉRMICO
Si en el universo se alcanzara el equilibrio y existiera en todos los lugares la misma temperatura eso supondría la muerte, la quietud, la falta de cambio.

Todos los cuerpos tienen una energía llamada energía interna. La cantidad de energía interna de un cuerpo es muy difícil de establecer ya que las partículas que forman un cuerpo tienen energías muy variadas. Tienen energías de tipo eléctrico, de rotación, de traslación y vibración debido a los movimientos que poseen, energías de enlace (que pueden dar posibles reacciones químicas) e incluso energía al desaparecer la materia y transformarse en energía DE=mc2 ....
Lo más fácil de medir es la variación de energía en un proceso de transformación concreto y si el proceso es sólo físico mucho mejor. (Ejemplos: calentamiento, cambios de estado...).
Al poner en contacto dos cuerpos a distinta temperatura, el de mayor temperatura cede parte de su energía al de menos temperatura hasta que sus temperaturas se igualan. Se alcanza así lo que llamamos "equilibrio térmico".
La energía calorífica (calor) no pasa del cuerpo que tiene más energía al que tiene menos sino del que tiene mayor temperatura al que la tiene menor.
Con el siguiente ejemplo aclaramos la anterior afirmación:
 Pulsa para ver foto ampliada del iceberg Pulsa para ver foto ampliada del iceberg |
Los mares (los océanos están intercomunicados) pueden ceder mucha más energía calorífica que mi cuerpo. El mar es capaz de fundir un iceberg y sus aguas apenas se enfrían unos grados. Yo, con el calor que puedo desprender en todos los días de mi vida (parte de las 2.100.000 calorías que consumo al día) fundiría muy pocas toneladas de iceberg.
Puede ceder mucho más calor el mar que mi cuerpo.
Pero si me sumerjo en el agua de mar el calor pasa de mi cuerpo al mar.
|
El calor fluye desde los cuerpos que están a más temperatura a los que están a temperatura menor.

Vamos a comprobarlo
Calentamos en un tubo de ensayo 25 ml H2O (agua) hasta una temperatura alta. Lo introducimos centrado en un vaso de precipitados mas grande que contiene 100 ml de agua. Medimos las temperaturas de los dos a intervalos de un minuto.
Agitamos el tubo de ensayo para homogeneizar la temperatura dentro y fuera y mantenemos la sonda externa alejada del tubo de ensayo.
Registramos los datos, los anotamos en una tabla y registramos gráficamente las temperaturas de cada uno frente al tiempo.
En nuestro caso el registro lo hizo el aparato electrónico y la gráfica nos la dio el mismo aparato, pero disponiendo de dos termómetros podemos anotar los datos y luego hacer la gráfica.
Los recursos electrónicos nos permiten hacer más rápidas y más bonitas las gráficas, pero los conceptos que se descubren se pueden obtener igualmente aunque no dispongamos de tantos recursos.

¿Puedes saber la temperatura inicial del foco caliente viendo la gráfica? ¿Y del foco frío?. ¿Cuál fue la temperatura final?
¿Cuánto tardaron en igualarse las temperaturas?
En el punto en que se igualan las T el foco frío queda momentáneamente a una temperatura inferior debido a un error de lectura experimental. Una agitación continuada de los dos líquidos en contacto las igualará.
Si dejamos el sistema abandonado las temperaturas del agua del tubo y del vaso continuarán iguales y empezarán a descender al mismo tiempo, porque los alrededores están a menor temperatura.
Las pendientes de las curvas obtenidas en los registros de las temperaturas hacia el equilibrio dependen de las masa y de los calores específicos de las sustancias puestas en contacto.
 | Si la curva de enfriamiento y la de calentamiento tienen la misma pendiente (una creciente y la otra decreciente) ¿qué puedes deducir? ¿Estará relacionado con que la masa del líquido caliente es igual a la del frío y se trata de la mismas sustancia? |
| Cambios de estado |
Cuando un cuerpo, por acción del calor o del frío pasa de un estado a otro, decimos que ha cambiado de estado. En el caso del agua: cuando hace calor, el hielo se derrite y si calentamos agua líquida vemos que se evapora. El resto de las sustancias también puede cambiar de estado si se modifican las condiciones en que se encuentran. Además de la temperatura, también la presión influye en el estado en que se encuentran las sustancias. Si se calienta un sólido, llega un momento en que se transforma en líquido. Este proceso recibe el nombre de fusión. El punto de fusión es la temperatura que debe alcanzar una sustancia sólida para fundirse. Cada sustancia posee un punto de fusión característico. Por ejemplo, el punto de fusión del agua pura es 0 °C a la presión atmosférica normal. Si calentamos un líquido, se transforma en gas. Este proceso recibe el nombre de vaporización. Cuando la vaporización tiene lugar en toda la masa de líquido, formándose burbujas de vapor en su interior, se denomina ebullición. También la temperatura de ebullición es característica de cada sustancia y se denomina punto de ebullición. El punto de ebullición del agua es 100 °C a la presión atmosférica normal. Simulación: (pulsa el botón para encender el mechero y observa los cambios) |
|
|
transmisión de calor
El calor se transmite de un lugar a otro de tres maneras diferentes:
Vamos a ver unos ejemplos de transmisión de calor
Ejemplo 1
Placa solar
El calor llega desde el Sol hasta la placa metálica por radiación. El metal de la placa emite radiación en el infrarrojo
Con esta sencilla placa, y dependiendo de la radiación solar, se alcanzan temperaturas muy altas. Probablemente hayas visto estas placas en los tejados de algunas casas. Busca en la red "placas solares"
Ejemplo 2
Recipiente metálico con agua al fuego
Ejemplo 3
Cocina vitrocerámica
En las cocinas vitrocerámicas la plancha de la cocina está fría y sólo sirve de soporte a la base del recipiente. En el fondo del recipiente se originan corrientes eléctricas inducidas por un campo magnético variable. La energía eléctrica pasa del interior de la cocina en forma de onda electromagnéticas (ondas originadas en un generador de campo magnético variable) hasta el fondo de la olla. Las ondas no interfieren con la plancha, pero si con el fondo del recipiente en el que se origina una corriente eléctrica que genera calor. Del fondo del recipiente pasa al líquido que está en contacto con él por conducción.
El calor circula dentro del líquido por convección y el fondo y las paredes radian en el infrarrojo.
Características de cada modo de transmisión
CONDUCCIÓN.- La conducción es el transporte de calor a través de una sustancia y tiene lugar cuando se ponen en contacto dos objetos a diferentes temperaturas. El calor fluye desde el objeto que está a mayor temperatura hasta el que la tiene menor. La conducción continúa hasta que los dos objetos alcanzan a la misma temperatura (equilibrio térmico).
Podemos explicarlo si tenemos en cuenta las "colisiones de las moléculas". En la superficie de contacto de los dos objetos las moléculas del objeto que tiene mayor temperatura, que se mueven más deprisa, colisionan con las del objeto que está a menor temperatura, que se mueven más despacio. A medida que colisionan, las moléculas rápidas ceden parte de su energía a las más lentas. Estas a su vez colisionan con otras moléculas contiguas. Este proceso continúa hasta que la energía se extiende a todas las moléculas del objeto que estaba inicialmente a menor temperatura. Finalmente alcanzan todas la misma energía cinética y en consecuencia la misma temperatura.
Algunas sustancias conducen el calor mejor que otras.
Los sólidos son mejores conductores que los líquidos y éstos mejor que los gases.
Los metales son muy buenos conductores del calor, mientras que el aire es un mal conductor.
CONVECCIÓN.- La convección tiene lugar cuando áreas de fluido caliente (de menor densidad) ascienden hacia las regiones de fluido frío. Cuando ocurre esto, el fluido frío (de mayor densidad) desciende y ocupa el lugar del fluido caliente que ascendió. Este ciclo da lugar a una continua circulación (corrientes convectivas) del calor hacia las regiones frías.
En los líquidos y en los gases la convección es la forma más eficiente de transferir calor.
En el verano, en una carretera recalentada, se puede ver como asciende de ella el aire caliente formando una columnas oscilantes. También se ve a veces como asciende el aire desde un radiador (el aire caliente sube y el frío baja).
El calor calienta el aire y el papel y además de hacer girar la espiral la alarga y llega a tocar la pinza lo que le impide seguir girando.
RADIACIÓN.- Tanto la conducción como la convección requieren la presencia de materia para transferir calor.
La radiación es un método de transferencia de calor que no precisa de contacto entre la fuente de calor y el receptor.
No se produce ningún intercambio de masa y no se necesita ningún medio material para que se transmita.
Por radiación nos llega toda la energía del Sol. Al llegar a la Tierra empieza un complicado ciclo de transformaciones: la captan las plantas y luego la consumimos nosotros, el agua se evapora, el aire se mueve....
La energía radiante del Sol se transmite a través del espacio vacío en forma de radiación que viaja a la velocidad de la luz . Entre las diferentes ondas que la componen hay radiación visible, ultravioleta, infrarroja etc. La ultravioleta es tan energética que puede ionizar la materia, pero la radiación infrarroja interfiere con los electrones de los átomos promocionándolos a un nivel superior y produce la agitación de los átomos y de las moléculas que se traduce en calor.
En los hornos microondas la energía generada para que vibren las moléculas de la sustancia que se calienta la transmiten ondas con una frecuencia inferior a las del infrarrojo. Ver tipos de radiaciones
 La radiación se produce cuando los electrones situados en niveles de energía altos caen a niveles de energía más bajos. La diferencia de energía entre estos niveles se emite en forma radiación electromagnética. Cuando esta energía es absorbida por los átomos de una sustancia los electrones de dichos átomos "salten" a niveles de energía superiores.
La radiación se produce cuando los electrones situados en niveles de energía altos caen a niveles de energía más bajos. La diferencia de energía entre estos niveles se emite en forma radiación electromagnética. Cuando esta energía es absorbida por los átomos de una sustancia los electrones de dichos átomos "salten" a niveles de energía superiores.
Todos los objetos absorben y emiten radiación. Este "applet" de java muestra como un átomo absorbe y emite radiación. Cuando la absorción de energía está equilibrada con la emisión, la temperatura del objeto permanece constante. Si la energía absorbida es mayor que la emitida la temperatura del objeto aumenta, y si ocurre lo contrario la temperatura disminuye.
La energía total radiada por un cuerpo caliente es proporcional a la cuarta potencia de su temperatura expresada como temperatura absoluta. E=cte· T4
Un cuerpo negro se define como aquel que absorbe todo el calor que cae sobre él.
Un cuerpo a una temperatura dada emite más con su superficie ennegrecida.
En esta página puedes ampliar tus conocimientos sobre la radiación infrarroja.
El calor se transmite de un lugar a otro de tres maneras diferentes:
- Por conducción entre cuerpo sólidos en contacto
- Por convección en fluidos (líquidos o gases)
- Por radiación a través del medio en que la radiación pueda propagarse
Vamos a ver unos ejemplos de transmisión de calor
Ejemplo 1
Placa solar
El calor llega desde el Sol hasta la placa metálica por radiación. El metal de la placa emite radiación en el infrarrojo
 | . El calor se transmite al líquido que está en contacto con la placa por conducción. En el líquido se establecen corrientes covectivas que lo mezclan y uniformizan el calor. El agua caliente sube y la fría baja. El agua más caliente sube al depósito superior y de la parte inferior de este depósito baja el agua más fría que entra por la parte de abajo de la placa |
Ejemplo 2
Recipiente metálico con agua al fuego
 | Las llamas (o una plancha eléctrica) calientan el metal porque los gases de combustión están en contacto con el fondo y le transmiten el calor por conducción (el metal se dilata y sus partículas vibran más). El metal transmite el calor al agua del fondo del recipiente por conducción. El agua caliente del fondo asciende, originando corrientes convectivas (propagación por convección) y se mezcla con el agua fría. Las paredes de los recipientes calientes emiten radiación en el infrarrojo a los alrededores. |
Ejemplo 3
Cocina vitrocerámica
En las cocinas vitrocerámicas la plancha de la cocina está fría y sólo sirve de soporte a la base del recipiente. En el fondo del recipiente se originan corrientes eléctricas inducidas por un campo magnético variable. La energía eléctrica pasa del interior de la cocina en forma de onda electromagnéticas (ondas originadas en un generador de campo magnético variable) hasta el fondo de la olla. Las ondas no interfieren con la plancha, pero si con el fondo del recipiente en el que se origina una corriente eléctrica que genera calor. Del fondo del recipiente pasa al líquido que está en contacto con él por conducción.
El calor circula dentro del líquido por convección y el fondo y las paredes radian en el infrarrojo.
Características de cada modo de transmisión
CONDUCCIÓN.- La conducción es el transporte de calor a través de una sustancia y tiene lugar cuando se ponen en contacto dos objetos a diferentes temperaturas. El calor fluye desde el objeto que está a mayor temperatura hasta el que la tiene menor. La conducción continúa hasta que los dos objetos alcanzan a la misma temperatura (equilibrio térmico).
Podemos explicarlo si tenemos en cuenta las "colisiones de las moléculas". En la superficie de contacto de los dos objetos las moléculas del objeto que tiene mayor temperatura, que se mueven más deprisa, colisionan con las del objeto que está a menor temperatura, que se mueven más despacio. A medida que colisionan, las moléculas rápidas ceden parte de su energía a las más lentas. Estas a su vez colisionan con otras moléculas contiguas. Este proceso continúa hasta que la energía se extiende a todas las moléculas del objeto que estaba inicialmente a menor temperatura. Finalmente alcanzan todas la misma energía cinética y en consecuencia la misma temperatura.
Algunas sustancias conducen el calor mejor que otras.
Los sólidos son mejores conductores que los líquidos y éstos mejor que los gases.
Los metales son muy buenos conductores del calor, mientras que el aire es un mal conductor.
CONVECCIÓN.- La convección tiene lugar cuando áreas de fluido caliente (de menor densidad) ascienden hacia las regiones de fluido frío. Cuando ocurre esto, el fluido frío (de mayor densidad) desciende y ocupa el lugar del fluido caliente que ascendió. Este ciclo da lugar a una continua circulación (corrientes convectivas) del calor hacia las regiones frías.
En los líquidos y en los gases la convección es la forma más eficiente de transferir calor.
En el verano, en una carretera recalentada, se puede ver como asciende de ella el aire caliente formando una columnas oscilantes. También se ve a veces como asciende el aire desde un radiador (el aire caliente sube y el frío baja).
 | En este gif animado ves como un mechero calienta el aire, éste asciende en una corriente convectiva y hace girar la espiral de papel. Hemos usado un agitador del calorímetro sujeto por una pinza y en él apoyamos un dedal en el que pegamos la espiral de papel.  |
RADIACIÓN.- Tanto la conducción como la convección requieren la presencia de materia para transferir calor.
La radiación es un método de transferencia de calor que no precisa de contacto entre la fuente de calor y el receptor.
No se produce ningún intercambio de masa y no se necesita ningún medio material para que se transmita.
Por radiación nos llega toda la energía del Sol. Al llegar a la Tierra empieza un complicado ciclo de transformaciones: la captan las plantas y luego la consumimos nosotros, el agua se evapora, el aire se mueve....
La energía radiante del Sol se transmite a través del espacio vacío en forma de radiación que viaja a la velocidad de la luz . Entre las diferentes ondas que la componen hay radiación visible, ultravioleta, infrarroja etc. La ultravioleta es tan energética que puede ionizar la materia, pero la radiación infrarroja interfiere con los electrones de los átomos promocionándolos a un nivel superior y produce la agitación de los átomos y de las moléculas que se traduce en calor.
En los hornos microondas la energía generada para que vibren las moléculas de la sustancia que se calienta la transmiten ondas con una frecuencia inferior a las del infrarrojo. Ver tipos de radiaciones

Todos los objetos absorben y emiten radiación. Este "applet" de java muestra como un átomo absorbe y emite radiación. Cuando la absorción de energía está equilibrada con la emisión, la temperatura del objeto permanece constante. Si la energía absorbida es mayor que la emitida la temperatura del objeto aumenta, y si ocurre lo contrario la temperatura disminuye.
La energía total radiada por un cuerpo caliente es proporcional a la cuarta potencia de su temperatura expresada como temperatura absoluta. E=cte· T4
Un cuerpo negro se define como aquel que absorbe todo el calor que cae sobre él.
Un cuerpo a una temperatura dada emite más con su superficie ennegrecida.
En esta página puedes ampliar tus conocimientos sobre la radiación infrarroja.
Publicado por EQUIPO #1 , 21:54
Los procesos termodinámicos comprenden el comportamiento y relación que se da entre las temperaturas, presión y el volumen es importante en diversos procesos industriales.
2.1.1 TERMODINÁMICA:
También es conocida como el movimiento del calor, en esta rama de la física se estudia la transferencia de calor en trabajo mecánico y viceversa. su principal base es la conservación de la energía.
Nos proporciona una teoría básica que nos sirve para entender y poder diseñar maquinas térmicas (refrigeradores, cohetes, etc.).
SISTEMA TERMODINAMICO:Es una parte del universo que se separa con la finalidad poderla estudiar. Para ello se aísla de los alrededores a través de límites o fronteras, de tal manera que todo lo que se encuentra fuera de lo delimitado se denomina alrededores.

a) Frontera:Es el limite que separa al sistema de lo alrededores, casi siempre son paredes que pueden ser diatérmicas o adiabáticas.
b) Pared diatérmicas:Es una conductora de calor, ésta permite el intercambio de calor entre el sistema y sus alrededores y al revés.
c) Pared adiabática:Es caracterizada por NO permitir la interacción térmica del sistema con los alrededores. Es construida de materiales no conductores del calor como porcelana o asbesto.
d) Equilibrio termodinámico:Se alcanza cuando después de cierto tiempo de poner en contacto un sistema de baja temperatura con otro sistema a mayor temperatura se iguala, por lo tanto existe un intercambio de calor, las propiedades de presión, densidad y temperatura cuando se encuentran en este punto dejan de variar.
e) Energía interna ( Ei):Es la energía contenida en el interior de las sustancias. Es la suma de energía cinética y potencial de las moléculas individuales que la forman. La mayoría de las veces se cumple cuanto mayor sea la temperatura de un sistema también lo será su energía interna.
La energía interna se hace presente en las sustancias combustibles y es proporcional a la masa.
2.1.2 EQUIVALENTE MECANICO DEL CALOR:
 Fue establecido por un físico ingles llamado James Prescott Joule (1818-1889), es autor de importantes trabajos sobre la TEORIA MECANICA DEL CALOR, a mediados del sigo XIX. Demostró que cierta variación de temperatura indica un cambio de energía interna y aparece que se pierde determinada cantidad de energía molecular.
Fue establecido por un físico ingles llamado James Prescott Joule (1818-1889), es autor de importantes trabajos sobre la TEORIA MECANICA DEL CALOR, a mediados del sigo XIX. Demostró que cierta variación de temperatura indica un cambio de energía interna y aparece que se pierde determinada cantidad de energía molecular.Después de varios experimentos en los cuales todos los resultados le daban 1J = 0.24 cal o 1 cal = 4.2J, concluyo que la energía mecánica y la energía que causaba la diferencia de temperatura eran equivalentes.
2.1.2 PRIMERA LEY DE LA TERMODINAMICA.
Esta ley dice que la variación de la energía interna de un sistema es igual a la energía que transfieren o reciben los alrededores en forma de calor y trabajo, de forma tal que se cumple la energía no se crea ni se destruye, solo se transforma.
La primera ley de la termodinámica se muestra matemáticamente de la siguiente manera:
Esta ley dice que la variación de la energía interna de un sistema es igual a la energía que transfieren o reciben los alrededores en forma de calor y trabajo, de forma tal que se cumple la energía no se crea ni se destruye, solo se transforma.
La primera ley de la termodinámica se muestra matemáticamente de la siguiente manera:

a) Peso termodinámico:Es cuando la temperatura, presión o volumen de un gas varían. Los procesos termodinámicos se clasifican en:
2.1.2 PROCESO ISOTERMICO:
Se presenta cuando la temperatura del sistema, permanece constante independientemente de los cambio de presión o volumen que sufran.

Este proceso se rige por la ley de Boyle-Mariotte de Robert Boyle (1626-1691), Físico Químico irlandés conocido por sus experimentos acerca de las propiedades de los gases
y Edme Mariotte (1620-1684), Físico Francés que descubrió la ley que relación la presión y el volumen de los gases a temperatura constante.
y Edme Mariotte (1620-1684), Físico Francés que descubrió la ley que relación la presión y el volumen de los gases a temperatura constante.
Si un proceso isotérmico formado por un gas experimenta una expansión isotérmica, para que la temperatura permanezca constante la cantidad de calor recibido debe ser igual al trabajo que realiza durante la expansión. Pero si presenta una compresión isotérmica, para que la temperatura también permanezca constante el gas tiene que liberar una cantidad de calor igual al trabajo desarrollado sobre él.
La temperatura no cambia, su energía interna (Ei), son constantes y su variación de energía interna (ΔEi) es igual a cero, por lo que se cumple que (Ei es constante) (ΔEi = 0 ) Q=Tr.
La temperatura no cambia, su energía interna (Ei), son constantes y su variación de energía interna (ΔEi) es igual a cero, por lo que se cumple que (Ei es constante) (ΔEi = 0 ) Q=Tr.
2.1.2 PROCESO ISOBARICO:
Es cuando hay una variación del volumen o temperatura y la presión permanece constante, no importando si el gas sufre una compresión o una expansión. Este proceso rige por la Ley de Charles: Jackes A. Charles ( 1742-1822). Químico, físico y aeronauta Frances, que fue el primero en hacer mediciones acerca de los gases que se expanden al aumentar la temperatura.
Las ecuaciones para el proceso isobárico son:
Es cuando hay una variación del volumen o temperatura y la presión permanece constante, no importando si el gas sufre una compresión o una expansión. Este proceso rige por la Ley de Charles: Jackes A. Charles ( 1742-1822). Químico, físico y aeronauta Frances, que fue el primero en hacer mediciones acerca de los gases que se expanden al aumentar la temperatura.
Las ecuaciones para el proceso isobárico son:

2.1.2 PROCESO ISOCORICO:Se presenta cuando el volumen del sistema permanece constante. Ya que la variación del volumen es cero, no se realiza trabajo sobre el sistema ni de éste último de sobre los alrededores, por lo que se cumple Tr = 0 Y ΔEi = Q, esto indica que todo el calor suministrado aumentara en la misma proporción a la energía interna, en general esto se presenta cuando un gas se calienta dentro de un recipiente con volumen fijo.
Cuando se calientan dos masas iguales de gas, a una presión constante y otra a volumen constante, para que logren el mismo incremento de temperatura se requiere proporcionar mayor calor al sistema a presión constante (Qp>Qv). Ello se debe a que en el proceso isobárico el calor suministrado se usa para aumentar la energía interna y efectuar trabajo, mientras que en el proceso isocórico todo el calor se usa para incrementar exclusivamente la energía interna.
Cuando se calientan dos masas iguales de gas, a una presión constante y otra a volumen constante, para que logren el mismo incremento de temperatura se requiere proporcionar mayor calor al sistema a presión constante (Qp>Qv). Ello se debe a que en el proceso isobárico el calor suministrado se usa para aumentar la energía interna y efectuar trabajo, mientras que en el proceso isocórico todo el calor se usa para incrementar exclusivamente la energía interna.
2.1.3 PROCESO ADIABATICO:
Ocurre cuando el sistema no crea ni recibe calor, cumpliéndose que (Q=0) y ΔEi = -Tr , aun cuando el gas puede presentar expansión o comprensión.
En resumen las condiciones que se tienen que cumplir para los procesos son termodinámicos son:

CALENTAMIENTO POR COMPRESION:
Si un gas sufre compresión rápida, disminuye su volumen, se produce calor y se incrementa la temperatura.
4 comentarios
Publicado por EQUIPO #1 , 21:01
ISOBARICO:Un dispositivo cilindro émbolo contiene un gas que está inicialmente a 1 Mpa y ocupa 0.020 m3. El gas se expande hasta un volumen final de 0.040 m3. Determine el trabajo obtenido en Kj para un proceso isobárico (a presión constante).
Para calcular el trabajo en procesos a presión constante se utiliza la Ec.
W1-2 = P (V2 – V1) =
Se tienen los volúmenes en metros cúbicos y la presión en unidades de mega pascales, hay que utilizar unidades homogéneas: Conociendo que un Kpa = Kj/ m3, se puede convertir la presión de Mpa a Kpa.
1 Mpa * 1000 Kpa = 1000 Kpa. 1 Mpa
Se sustituye en la Ec.4: W1-2 = P (V2 – V1) = 1000 Kj/ m3 *(0.040 m3 – 0.020 Kj/ m3)
W1-2 = 20Kj
Un gas ideal en el que C v = 5.n.R/2 es trasladado del punto "a" al punto "b" Siguiendo los caminos acb, adb y ab, la presión y el volumen finales son P 2 = 2P 1 y V 2 = 2V 1 . a) Calcular el calor suministrado al gas, en función de n, R y T 1 en cada proceso. b) Cual es la capacidad calorífica en función de R para el proceso ab.

Aplicando el primer principio de la termodinámica podemos escribir:

Para cualquiera de los procesos que hemos de considerar, la variación de energía interna será el mismo puesto que U es una función de estado y solo depende de los puntos inicial y final del proceso. Por tratarse de un gas perfecto, podemos escribir :

Pero, de la ecuación de los gases perfectos, obtenemos :

por lo que, sustituyendo

Calculamos el trabajo en cada uno de los procesos :


En el caso de W ab no conocemos el tipo de proceso que sigue el gas, pero podemos ver que el trabajo vendrá dado por :

Obtenidos todos los datos necesarios podemos calcular el calor suministrado al gas en cada uno de los procesos :

Finalmente, la capacidad calorífica para el proceso ab será, en realidad, la capacidad calorífica media que podemos calcular mediante:

Un sistema cerrado, inicialmente en reposo sobre la tierra, es sometido a un proceso en el que recibe una transferencia neta de energía por trabajo igual a 200KJ. Durante este proceso hay una transferencia neta de energía por calor desde el sistema al entorno de 30KJ. Al final del proceso el sistema tiene una velocidad de 60m/s y una altura de 60m. La masa del sistema es 25Kg, y la aceleración local de la gravedad es g=9,8m/s2. Determinar el cambio de energía interna del sistema para el proceso.

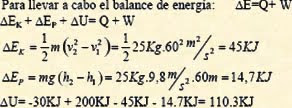
CANTIDAD DE CALOR
Cuando una sustancia se está fundiendo o evaporándose está absorbiendo cierta cantidad de calor llamada calor latente de fusión o calor latente de evaporación, según el caso. El calor latente, cualquiera que sea, se mantiene oculto, pero existe aunque no se manifieste un incremento en la temperatura,ya que mientras dure la fundición o la evaporación de la sustancia no se registrará variación de la misma.
Para entender estos conceptos se debe conocer muy bien la diferencia entre calor y temperatura.
En tanto el calor sensible es aquel que suministrado a una sustancia eleva su temperatura.
La experiencia ha demostrado que la cantidad de calor tomada (o cedida) por un cuerpo es directamente proporcional a su masa y al aumento (o disminución) de temperatura que experimenta.
La expresión matemática de esta relación es la ecuación calorimétrica:
Q = m·Ce·(Tf-Ti)
 En palabras más simples, la cantidad de calor recibida o cedida por un cuerpo se calcula mediante esta fórmula, en la cual m es la masa, Ce es el calor específico, Ti es la temperatura inicial y Tf la temperatura final. Por lo tanto Tf – Ti = ΔT (variación de temperatura).
En palabras más simples, la cantidad de calor recibida o cedida por un cuerpo se calcula mediante esta fórmula, en la cual m es la masa, Ce es el calor específico, Ti es la temperatura inicial y Tf la temperatura final. Por lo tanto Tf – Ti = ΔT (variación de temperatura).
Nota: La temperatura inicial (Ti) se anota también como T0 o como t0.
Si Ti > Tf el cuerpo cede calor Q < 0
Si Ti < Tf el cuerpo recibe calor Q > 0
Se define calor específico (Ce) como la cantidad de calor que hay que proporcionar a un gramo de sustancia para que eleve su temperatura en un grado centígrado. En el caso particular del agua Ce vale 1 cal/gº C ó 4,186 J.


MEDIDA DEL CALOR
De acuerdo con el principio de conservación de la energía, suponiendo que no existen pérdidas, cuando dos cuerpos a diferentes temperaturas se ponen en contacto, el calor tomado por uno de ellos ha de ser igual en cantidad al calor cedido por el otro. Para todo proceso de transferencia calorífica que se realice entre dos cuerpos puede escribirse entonces la ecuación:
Q1 = - Q2
en donde el signo - indica que en un cuerpo el calor se cede, mientras que en el otro se toma. Recurriendo a la ecuación calorimétrica, la igualdad anterior puede escribirse en la forma:
m1 · c1 · (Te - T1) = -m2 · c2 · (Te - T2)
(6)
donde el subíndice 1 hace referencia al cuerpo frío y el subíndice 2 al caliente. La temperatura Te en el equilibrio será superior a T1 e inferior a T2.
La anterior ecuación indica que si se conocen los valores del calor específico, midiendo temperaturas y masas, es posible determinar cantidades de calor. El aparato que se utiliza para ello se denomina calorímetro. Un calorímetro ordinario consta de un recipiente de vidrio aislado térmicamente del exterior por un material apropiado. Una tapa cierra el conjunto y dos pequeños orificios realizados sobre ella dan paso al termómetro y al agitador, los cuales se sumergen en un líquido llamado calorimétrico, que es generalmente agua.
Cuando un cuerpo a diferente temperatura que la del agua se sumerge en ella y se cierra el calorímetro, se produce una cesión de calor entre ambos hasta que se alcanza el equilibrio térmico. El termómetro permite leer las temperaturas inicial y final del agua y con un ligero movimiento del agitador se consigue una temperatura uniforme. Conociendo el calor específico y la masa del agua utilizada, mediante la ecuación calorimétrica se puede determinar la cantidad de calor cedida o absorbida por el agua.
En este tipo de medidas han de tomarse las debidas precauciones para que el intercambio de calor en el calorímetro se realice en condiciones de suficiente aislamiento térmico. Si las pérdidas son considerables no será posible aplicar la ecuación de conservación Q1 = - Q2 y si ésta se utiliza los resultados estarán afectados de un importante error.
La ecuación (6) puede aplicarse únicamente a aquellos casos en los cuales el calentamiento o el enfriamiento del cuerpo problema no lleva consigo cambios de estado físico (de sólido a líquido o viceversa, por ejemplo). A partir de ella y con la ayuda del calorímetro es posible determinar también el calor específico del cuerpo si se conocen las temperaturas T1, T2 y Te, las masas m1 y m2 y el calor específico del agua.
Suscribirse a:
Entradas (Atom)



